Întrebarea despre ce este electroliza a fost discutată încă de la cursul de fizică din școală și nu este un secret pentru majoritatea oamenilor. Un alt lucru este importanța și aplicarea sa practică. Acest procedeu este utilizat în mod avantajos în diverse industrii și poate fi util pentru meșterul casnic.
Cuprins
- 1 Ce este electroliza?
- 2 Legile lui Faraday ale electrolizei
- 3 Electroliza topiturilor
- 4 Caracteristici ale electrolizei în soluții
- 5 Electroliza în gaze
- 6 Caracteristicile proceselor care au loc la catod și anod
- 7 Factori care afectează procesul de electroliză
- 8 Unde se aplică electroliza?
- 9 Costuri energetice
Ce este electroliza?
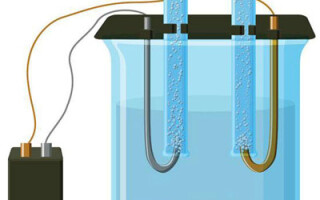
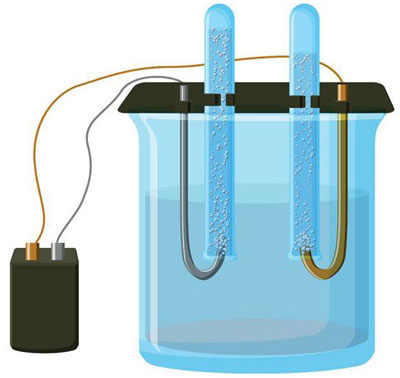
Electroliza este un complex de procese specifice într-un sistem de electrozi și electroliți cu un curent electric constant. Mecanismul său se bazează pe generarea unui curent ionic. Electrolitul este un conductor de tip 2 (conductivitate ionică) în care are loc disocierea electrolitică. Aceasta presupune descompunerea în ioni cu valori pozitive (cation) și negativ (anion).
Un sistem de electroliză conține în mod necesar un element pozitiv (anod) și unul negativ (catod) electrod. Atunci când se aplică un curent electric continuu, cationii se deplasează spre catod, iar anionii spre anod. Cationii sunt în principal ioni metalici și hidrogen, în timp ce anionii sunt oxigen și clor. La catod, cationii atașează electronii în exces, permițând astfel reacția de reducere Men+ + ne → Me (unde n este valența metalului). La anod, dimpotrivă, electronii sunt returnați de la anion, având loc o reacție de oxidare.
Astfel, procesul redox este asigurat în sistem. Ceea ce este important, însă, este faptul că acest proces necesită energie. Aceasta trebuie să fie asigurată de o sursă externă de curent.
Legile lui Faraday ale electrolizei
Marele fizician M. Faraday nu numai că a făcut posibilă, prin cercetările sale, înțelegerea naturii electrolizei, dar a făcut și calculele necesare pentru a o realiza. În 1832 au apărut legile sale, care leagă principalii parametri ai proceselor care au loc.
Prima lege
Prima lege a lui Faraday afirmă că masa de materie redusă pe anod este direct proporțională cu sarcina electrică indusă în electrolit: m = kq = k*I*t, unde q este sarcina, k este coeficientul sau echivalentul electrochimic al substanței, I este curentul care circulă prin electrolit, t este timpul de curgere a curentului.

A doua lege
A doua lege a lui Faraday a făcut posibilă determinarea coeficientului de proporționalitate k. Aceasta este următoarea: echivalentul electrochimic al oricărei substanțe este direct proporțional cu masa molară a acesteia și invers proporțional cu valența sa. Legea este exprimată în forma:

k = 1/F*A/zunde F este constanta lui Faraday, A este masa molară a substanței, z este valența chimică a acesteia.
Luând în considerare ambele legi, putem obține formula finală pentru calcularea masei substanței depuse pe electrod: m = A*I*t/(n*F)unde n este numărul de electroni implicați în electroliză. De obicei, n corespunde sarcinii ionului. Din punct de vedere practic, este important să se raporteze masa substanței la curentul aplicat, ceea ce permite controlul procesului prin variația intensității acestuia.
Electroliza topiturilor
O variantă a electrolizei constă în utilizarea unui topit ca electrolit. În acest caz, doar ionii de topire sunt implicați în procesul electrolitic. Un exemplu clasic este electroliza sării topite NaCl (sare de masă). Ionii negativi se îndreaptă spre anod, ceea ce înseamnă că se eliberează gaz (Cl). La catod va avea loc o reducere a metalului, adică o sedimentare a Na pur, format din ionii pozitivi care au atras electroni în exces. Alte metale pot fi produse într-un mod similar (K, Ca, Li etc.) de la dizolvarea sărurilor respective.
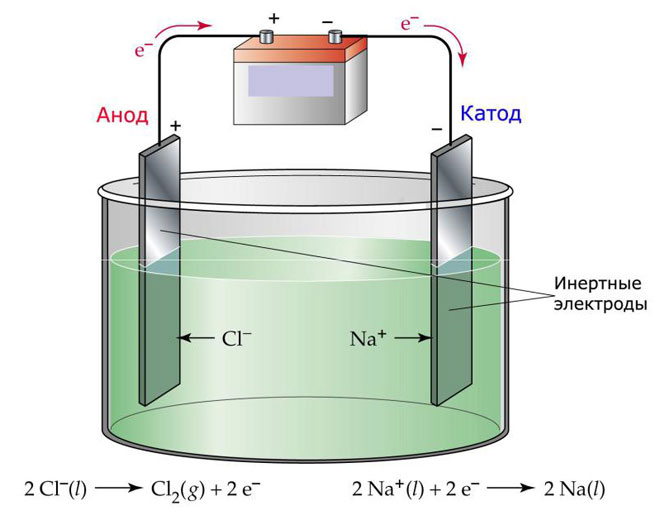
În cazul electrolizei topite, electrozii nu suferă dizolvare, ci doar participă ca sursă de curent. La fabricarea lor se pot utiliza metale, grafit și unii semiconductori. Este important ca materialul să aibă o conductivitate suficientă. Unul dintre cele mai comune materiale este cuprul.
Caracteristici ale electrolizei în soluții
Electroliza într-o soluție apoasă este destul de diferită de electroliza în topitură. În acest caz, există 3 procese concurente: oxidarea apei care produce oxigen, oxidarea anionului și dizolvarea anodică a metalului. Procesul implică ioni de apă, electrolit și anod. În consecință, reducerea hidrogenului, a cationilor din electrolit și a metalului anodic poate avea loc la catod.

Capacitatea acestor procese concurente de a avea loc depinde de potențialul electric al sistemului. Va avea loc doar procesul care necesită mai puțină energie externă. Prin urmare, cationii cu cel mai mare potențial electrodic vor fi reduși la catod, iar anionii cu cel mai mic potențial vor fi oxidați la anod. Potențialul de electrod al hidrogenului este considerat "0". De exemplu, în potasiu este egal cu (-2,93 В), sodiul este (-2,71 В), plumb (-0,13 В), iar pentru argint este (+0,8 В).
Electroliza în gaze
Gazul poate acționa ca un electrolit numai dacă este prezent un ionizator. În acest caz, curentul trece prin mediul ionizat, provocând procesul necesar la electrozi. Legile lui Faraday nu se aplică la electroliza gazelor. Aceste condiții sunt necesare pentru realizarea sa:
- Nici tensiunea înaltă, nici curentul înalt nu pot ajuta fără o ionizare artificială a gazului.
- Numai acizii gazoși fără oxigen și anumite gaze sunt adecvate pentru electroliză.
Important! Procesul se va desfășura în mod similar cu electroliza într-un electrolit lichid, dacă sunt îndeplinite condițiile necesare.
Caracteristici ale proceselor care au loc la catod și anod
Pentru aplicarea practică a electrolizei, este important să înțelegem ce se întâmplă la ambii electrozi atunci când se aplică un curent electric. Următoarele procese sunt caracteristice:
- Catod. Ionii încărcați pozitiv se îndreaptă spre el. Aici are loc reducerea metalelor sau eliberarea de hidrogen. Mai multe categorii de metale pot fi distinse în funcție de activitatea lor cationică. Metale precum Li, K, Ba, Ba, St, Ca, Na, Mg, Be, Al se reduc bine numai din săruri topite. În cazul în care se utilizează o soluție, hidrogenul este eliberat prin electroliza apei. Următoarele metale pot fi recuperate în soluție, dar la o concentrație suficientă de cationi - Mn, Cr, Zn, Fe, Cd, Ni, Ti, Co, Mo, Sn, Pb. Procesul este cel mai ușor pentru Ag, Cu, Bi, Pt, Au, Hg.
- Anod. Acest electrod este alimentat cu ioni încărcați negativ. Pe măsură ce se oxidează, acestea iau electroni de la metal, ceea ce duce la dizolvarea anodică a acestora, adică. Anionii sunt transformați în ioni încărcați pozitiv, care sunt direcționați spre catod. Anionii sunt, de asemenea, subdivizați în funcție de activitatea lor. Numai anionii PO4, CO3, SO4, NO3, NO2, ClO4, F pot fi evacuați din topituri. În soluțiile apoase, acestea nu sunt supuse electrolizei, ci apei cu eliberarea de oxigen. Anionii precum OH, Cl, I, S și Br sunt cei care reacționează cel mai ușor.

Atunci când se asigură electroliza, este important să se ia în considerare tendința de oxidare a materialului electrodului. Se face o distincție între anozi inerți și anozi activi. Electrozii inerți sunt confecționați din grafit, carbon sau platină și nu sunt implicați în alimentarea cu ioni.
Factori care afectează procesul de electroliză
Procesul de electroliză depinde de următorii factori
- Compoziția electrolitului. Diferitele impurități exercită o influență semnificativă. Aceștia sunt împărțiți în 3 tipuri - cationi, anioni și substanțe organice. Substanțele pot fi mai mult sau mai puțin negative decât metalul de bază, iar acest lucru interferează cu procesul. Printre impuritățile organice se numără poluanții (de exemplu, uleiuri) și agenții tensioactivi. Concentrațiile acestora sunt la valorile maxime admise.
- Densitatea curentului. În conformitate cu legea lui Faraday, masa substanței depuse crește odată cu intensitatea curentului. Cu toate acestea, apar circumstanțe nefavorabile - polarizare concentrată, tensiune crescută, încălzire intensă a electrolitului. Având în vedere acest lucru, există valori optime pentru densitatea de curent în fiecare caz.
- pH-ul electrolitului. Aciditatea mediului este, de asemenea, selectată în funcție de metale. De exemplu, pH-ul optim pentru zinc este de 140g/cc.
- Temperatura electrolitului. Acest lucru are un efect ambiguu. Pe măsură ce temperatura crește, rata de electroliză crește, dar și activitatea impurităților. Există o temperatură optimă pentru fiecare proces. De obicei, aceasta se situează între 38 și 45 de grade.
Important! Electroliza poate fi accelerată sau încetinită de diferite influențe și de alegerea compoziției electrolitului. Pentru fiecare aplicație există un regim diferit care trebuie respectat cu strictețe.
Unde se utilizează electroliza?
Electroliza este utilizată în numeroase aplicații. Există mai multe utilizări principale care pot fi distinse pentru rezultate practice.
Galvanoplastie
Prin electroliză se poate aplica un strat galvanic subțire și dur de metal. Elementul acoperit este plasat într-o baie ca și catod, iar electrolitul conține o sare a metalului dorit. Iată cum puteți acoperi oțelul cu zinc, crom sau staniu.

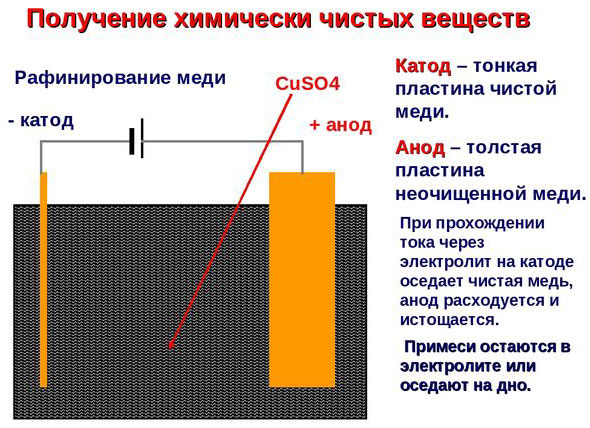
Electro-rafinare - rafinarea cuprului
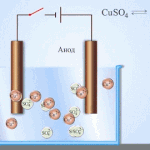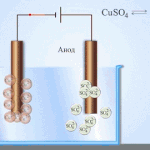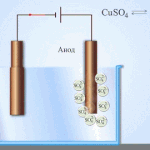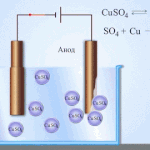
Un exemplu de proces de electrotratare ar fi catod - cupru pur anod - cupru cu impurități, electrolit - soluție apoasă de sulfat de cupru. Cuprul din anod se transformă în ioni și se depune în catod fără impurități.
Extracția metalelor
Pentru a extrage metalele din săruri, metalele sunt topite și apoi electrolizate în topitură. Acest proces este destul de eficient în recuperarea aluminiului din bauxită, a sodiului și a potasiului.

Anodizare
În acest proces, acoperirea este realizată din compuși nemetalici. Exemplul clasic este anodizarea aluminiului. Partea din aluminiu este montată ca un anod. Electrolitul este o soluție de acid sulfuric. Ca urmare a electrolizei, pe anod se depune un strat de oxid de aluminiu, care are proprietăți de protecție și decorative. Tehnologiile de mai sus sunt utilizate pe scară largă în diferite industrii. De asemenea, este posibil să efectuați procesele cu propriile mâini și într-un mod sigur.
Costuri energetice
Electroliza necesită o cantitate mare de energie. Procesul va avea valoare practică dacă curentul anodic este suficient, ceea ce necesită aplicarea unui curent continuu semnificativ de la sursa de energie. În plus, aceasta produce pierderi de tensiune laterală - supratensiuni anodice și catodice și pierderi în electrolit datorită rezistenței acestuia. Eficiența unei instalații se determină prin raportarea puterii de intrare a energiei la unitatea de masă utilă a substanței obținute.
Electroliza a fost folosită de mult timp în industrie cu o eficiență ridicată. Anodizarea și galvanizarea au devenit un lucru obișnuit în viața de zi cu zi, iar extracția și prelucrarea materialelor ajută la extragerea multor metale din minereu. Procesul poate fi planificat și calculat prin cunoașterea modelelor sale de bază.
Articole conexe: